I. Khái niệm đồng đẳng, đồng phân, danh pháp
- Định nghĩa: ankan (parafin) là những hiđrocacbon no, mạch hở.- Công thức chung: CnH2n+2 (n ≥ 1).
- Tên gọi:
+ Tên thay thế:
Số chỉ vị trí nhánh + tên nhánh + tên mạch chính + an
+ Tên thường:Nếu chỉ có một nhánh duy nhất CH3 ở nguyên tử C số 2 thì thêm tiền tố iso, nếu có 2 nhánh CH3 ở C số 2 thì thêm tiền tố neo. Chú ý phân biệt isoankan với isoankyl và neoankan với neoankyl. Isooctan là 2,2,4 – trimetylpentan.
- Đồng phân: mạch C.
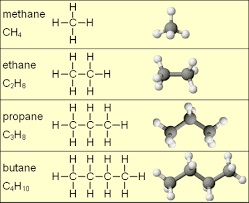
Một số ankan đơn giản thường gặp
II. Tính chất vật lí
- Ở nhiệt độ thường, các ankan từ C1 đến C4 ở trạng thái khí; từ C5 đến khoảng C18 ở trạng thái lỏng; từ khoảng C18 trở lên ở trạng thái rắn.- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của ankan nói chung đều tăng theo số nguyên tử C trong phân tử tức là tăng theo phân tử khối. Ankan nhẹ hơn nước.
- Ankan không tan trong nước và đều là những chất không màu.
III. Tính chất hóa học
1. Phản ứng thế (Cl2/as hoặc Br2/t0)
CnH2n+2 + xX2 → CnH2n+2-xXx + xHX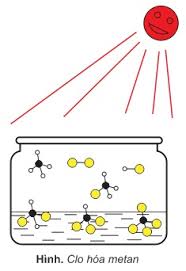
- Khả năng phản ứng: Cl2 > Br2 > I2 và Cbậc 3> Cbậc 2 > Cbậc 1. Sản phẩm chính là sản phẩm ưu tiên thế X vào H của C bậc cao (C có ít H hơn). C bậc a là C liên kết với a nguyên tử C khác.
- Phản ứng thế xảy ra theo cơ chế gốc tự do - dây chuyền gồm 3 giai đoạn:
+ Khơi mào phản ứng:
X2 → 2X.
+ Phát triển mạch:
X. + CnH2n+2 → CnH2n+1. + HX
CnH2n+1. + X2 → CnH2n+1X + X.
CnH2n+1. + X2 → CnH2n+1X + X.
+ Tắt mạch:
2X. → X2
X. + CnH2n+1. → CnH2n+1X
CnH2n+1. + CnH2n+1. → C2nH4n+2
Lưu ý: Số sản phẩm thế 1 lần (monohalogen) cũng chính là số gốc ankyl mà các đồng phân tạo ra = số loại nguyên tử H tương đương = số loại nguyên tử C tương đương (trừ C bậc 4).X. + CnH2n+1. → CnH2n+1X
CnH2n+1. + CnH2n+1. → C2nH4n+2
2. Các phản ứng xảy ra do tác dụng của nhiệt
a. Phản ứng tách H2 (phản ứng đề hiđro hóa)CnH2n+2 → CnH2n + H2 (Fe, t0)
Anken
Chú ý:
- Chỉ những ankan trong phân tử có từ 2 nguyên tử C trở lên mới có khả năng tham gia phản ứng tách H2.
- Trong phản ứng tách H2, 2 nguyên tử H gắn với 2 nguyên tử C nằm cạnh nhau tách ra cùng nhau và ưu tiên tách H ở C bậc cao.
CH3-CH2-CH3 → CH2=CH-CH3 + H2
- Một số trường hợp riêng khác: CH3-CH2-CH2-CH3 → 2H2 + CH2=CH-CH=CH2
CH3-CH(CH3)-CH2-CH3 → CH2=C(CH3)-CH=CH2 + 2H2
n-C6H14 → 4H2 + C6H6 (benzen)
n-C7H16 → 4H2 + C6H5CH3 (toluen)
- Phản ứng phân hủy bởi nhiệt:
CnH2n+2 → nC + (n + 1)H2 (t0)
- Phản ứng phân hủy bởi halogen (Cl2 hoặc F2): CnH2n+2 + nCl2 → CnCl2n+2 + (n + 1)H2 (t0)
c. Phản ứng crăcking (n≥ 3) CnH2n+2 → CxH2x+2 + CyH2y (t0, p, xt)
Chú ý:+ Ankan thẳng CnH2n+2 khi crăcking có thể xảy ra theo (n - 2) hướng khác nhau tạo ra 2(n-2) sản phẩm.
+ Nếu hiệu suất phản ứng crăcking là 100% và không có quá trình cracking thứ cấp thì tổng số mol sản phẩm tăng gấp đôi so với các chất tham gia nên KLPTTB giảm đi một nửa.
+ Số mol ankan sau phản ứng luôn bằng số mol ankan ban đầu dù quá trình cracking có nhiều giai đoạn.
3. Phản ứng cháy
CnH2n+2 + (3n + 1)/2O2 → nCO2 + (n + 1)H2O- Đối với phản ứng cháy của ankan cần lưu ý 2 đặc điểm:
+ nCO2 < nH2O.
+ nH2O - nCO2 = nankan bị đốt cháy.
- Nếu đốt cháy 1 hiđrocacbon mà thu được nCO2 < nH2O thì hiđrocacbon đem đốt cháy thuộc loại ankan.
- Nếu đốt cháy hỗn hợp hiđrocacbon cho nCO2 < nH2O thì trong hỗn hợp đốt cháy có chứa ít nhất 1 ankan.
Chú ý: Nếu cho ankan tham gia phản ứng với oxi khi có mặt muối Mn2+ thì xảy ra phản ứng oxi hóa không hoàn toàn tạo RCOOH.
R-CH2-CH2-R + 5/2O2 → 2RCOOH + H2O
IV. Điều chế
- Thực hiện phản ứng tổng hợp Wuyêc: CnH2n+1X + CmH2m+1X + 2Na → CnH2n+1 - CmH2m+1 + 2NaX (t0)
- Nhiệt phân muối Natri của axit cacboxylic (phản ứng vôi tôi xút): CnH2n+2-x(COONa)x + xNaOH → CnH2n+2 + xNa2CO3 (CaO, t0)
- Cộng hiđro vào hiđrocacbon không no hoặc vòng không bền: CnH2n+2-2k + kH2 → CnH2n+2 (Ni, t0)
- Riêng với CH4 có thể dùng phản ứng: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Al4C3 + 12HCl → 4AlCl3 + 3CH4
C + 2H2 → CH4 (xúc tác, t0)
Tách từ nguồn khí thiên nhiên.Al4C3 + 12HCl → 4AlCl3 + 3CH4
C + 2H2 → CH4 (xúc tác, t0)
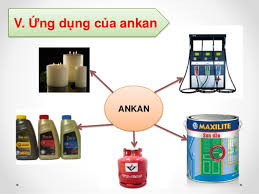
V. Ứng dụng
Bài viết liên quan:

Ý kiến bạn đọc