I. Một số khái niệm
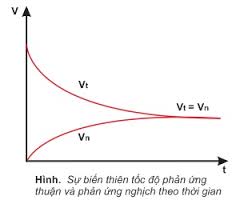
- Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều thuận và nghịch trong cùng điều kiện.- Cân bằng hoá học là trạng thái của hệ phản ứng thuận nghịch mà ở đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
- Biểu thức tính hằng số cân bằng của phản ứng thuận nghịch: nA + mB ↔ pC + qD là:
Kcb =[C]p.[D]q/[A]a.[B]b
Chú ý: hằng số tốc độ của phản ứng cũng như hằng số cân bằng của phản ứng thuận nghịch chỉ phụ thuộc vào yếu tố nhiệt độ.II. Sự chuyển dịch cân bằng hoá học
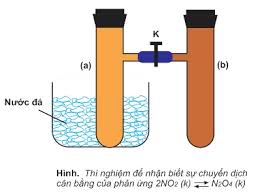
- Khi hệ phản ứng thuận nghịch đang ở trạng thái cân bằng nếu ta thay đổi điều kiện nào đó thì cân bằng hoá học sẽ bị phá vỡ và hệ sẽ chuyển dịch đến một trạng thái cân bằng mới.- Nguyên lí chuyển dịch cân bằng LơSatơlie: Khi ta thay đổi điều kiện nào đó của cân bằng hoá học thì cân bằng sẽ chuyển dịch theo chiều chống lại ảnh hưởng của sự thay đổi đó. Cụ thể là:
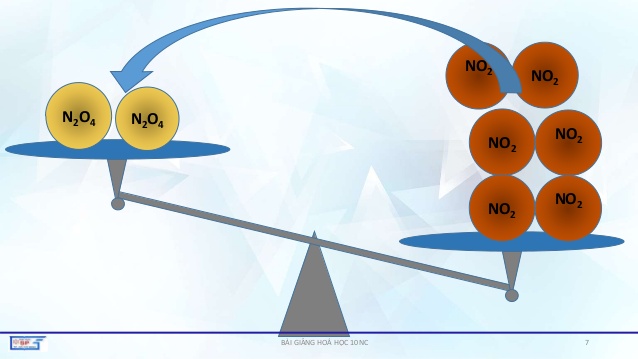
+ Nếu tăng nồng độ một chất thì CBHH sẽ chuyển dịch theo chiều mà chất đó là chất tham gia phản ứng, còn nếu giảm nồng độ của một chất thì CBHH sẽ chuyển dịch theo chiều sinh ra chất đó.
+ Khi tăng nhiệt độ thì cân bằng hoá học chuyển dịch theo chiều phản ứng thu nhiệt (có ΔH > 0). Còn khi giảm nhiệt độ thì CBHH sẽ chuyển dịch theo chiều của phản ứng toả nhiệt (có ΔH < 0).
+ Chất xúc tác không làm chuyển dịch CBHH mà chỉ làm cho hệ nhanh đạt đến trạng thái cân bằng.
Bài viết liên quan:
Ý kiến bạn đọc