I. Vị trí nguyên tố
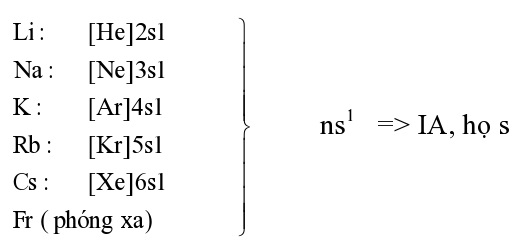
Mạng tinh thể lập phương tâm khối
II. Tính chất vật lí
- R lớn nhất trong 1 chu kì => Liên kết kim loại yếu
- Nhiệt độ nóng chảy, nhiệt độ sôi thấp Li Cs
- Độ cứng nhỏ
- D < 5 g/cm3
III. Tính chất hóa học
R mã , độ âm điện nhỏ, I1 thấp => tính khử mạnh
M → M+ + e (tăng dần Li Cs)
1. Tác dụng với phi kim
2M + H2 → 2MH
Thí dụ:
4Na + O2 2Na2O
2Na + O2 → Na2O2
natripeoxit
6Li + N2 → 2LiN3
2. Tác dụng với nước (EoM+/M < 0)
Na + H2O → NaOH + ½ H2
M + H2O → M+ + OH- + ½ H2
3. Tác dụng với dd axit
Na + HCl → NaCl + ½ H2↑
Na dư + H2O → NaOH + ½ H2↑
4. Tác dụng với dd muối
Khi cho Na tác dụng với dd muối CuSO4
2 Na +2H2O →2NaOH +H2↑
2 NaOH+ CuSO4→Na2SO4 +Cu(OH)2$
IV. Ứng dụng
Kim lọai kiềm có nhiều ứng dụng quan trọng như:
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy,…
- Các kim lọai Na và K dùng làm chất trao đổi nhiệt trong 1 vài lọai lò phản ứng hạt nhân
- Kim lọai xesi dùng chế tạo tế bào quang điện
- Điều chế 1 số kim lọai hiếm bằng phương pháp nhiệt luyện
- Dùng nhiều trong tổng hợp hữu cơ
V. Điều chế
- Trong tự nhiên kim lọai kiềm chỉ tồn tại ở dạng hợp chất.
- Phương pháp thường dùng để điều chế kim lọai kiềm là điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
Thí dụ :
*Na được điều chế bằng cách điện phân nóng chảy hỗn hợp NaCl với 25% NaF và 12% KCl ở nhiệt độ cao, cực dương than chì và cực âm làm bằng Fe.
2NaCl → 2Na + Cl2
* Li được điều chế bằng cách điện phân hỗn hợp LiCl và KCl
* Rb và Cs được điều chế bằng cách dung kim loại Ca khử các clorua ở nhiệt độ cao và trong chân không:
2RbCl + Ca → CaCl2 + 2Rb
CaC2 + 2CsCl → 2C + CaCl2 + 2Cs
Bài viết liên quan:

Ý kiến bạn đọc