1. Một số khái niệm:
● Cặp oxi hóa-khử của KL
Dạng oxi hóa và dạng khử của cùng một nguyên tố KL tạo nên cặp oxi hóa-khử: Dạng oxi hóa / dạng khử.Ví dụ: ;Cu2+/Cu ; Fe3+/Fe2+; Ag2+/Ag
● Pin điện hóa:
Là thiết bị gồm 2 thanh KL nhúng trong dung dịch muối của nó được nối bằng cầu muối.
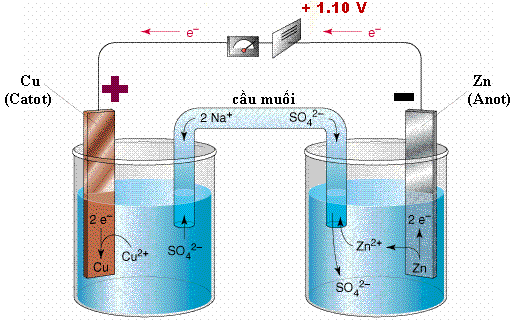
- Lá Zn bị ăn mòn vì Zn bị oxi hóa:
Zn → Zn2+ + 2e-
Các e này di chuyễn qua lá Cu thông qua dây dẫn (làm kim vôn kế bị lệch).
- Trong dung dịch CuSO4 các ion Cu2+ di chuyễn đến lá Cu, tại đây chúng bị
khử thành Cu, rồi bám lên lá Cu.
Cu2+ + 2e → Cu.
Ion Cu2+ trong dung dịch bị giảm dần về nồng độ.
- vai tró của cầu muối: trung hòa điện tích của 2 dung dịch: các ion dương
NH+4 hoặc K+ và Zn2+ di chuyễn qua cầu muối đến cốc đựng dung dịch
CuSO4. ngược lại các ion âm NO3-, SO42- di chuyễn qua cầu muối đến cốc
đựng dung dịch ZnSO4.
Zn đóng vai trò điện cực âm (Anot) là nơi xảy ra sự oxi hóa.
Cu đóng vai trò điện cực dương (catot) là nơi xảy ra sự k
● Thế điện cực:
Sự xuất hiện dòng điện đi từ cực đồng sang cực kẽm chứng tỏ rằng có sự chênh lệch điện thế giữa 2 điện cực kẽm và đồng tức là mỗi điện cực xuất hiện một thế điện cực nhất định.● Suất điện động:
Hiệu của thế điện cực dương (E(+)) với thế điện cực âm (E(-)) được gọi là suất điện động của pin điện hóa:
Epin = E(+) - E(-)
(ở ví dụ này E0pin = E0(Cu2+/ Cu) - E0(Zn2+/Zn)).
● Điện cực hidro chuẩn:
Tấm platin (Pt) nhúng trong dung dịch axit có nồng độ ion H+ là 1 M. Bề mặt được hấp phụ bởi khí hidro dưới áp suất 1atm. E02H+/ H2 = 0,00 V.● Thế điện cực chuẩn kim loại:
- Điện cực KL mà nồng độ ion KL trong dung dịch bằng 1M được gọi là điện cực chuẩn.- Thế điện cực chuẩn của KL cần đo được chấp nhận bằng sđd của pin tạo bởi điện cực hidro chuẩn và điện cực chuẩn của KL cần đo.
- Nếu KL đóng vai cực âm, thì thế điện cực chuẩn của KL có giá trị âm, nếu đóng vai trò cực dương thì thế điện cực chuẩn của KL có gía trị dương.
2. Ý nghĩa của dãy thế điện cực chuẩn của KL.
● So sánh tính oxi hóa-khử:
Trong dung dịch nước thế điện cực chuẩn của KL E0Mn+/ M càng lớn thì tính oxi hóa của cation Mn+ và tính khử của KL M càng yếu. (ngược lại).● Xác định chiều của phản ứng oxi-hóa khử:
Cation KL trong cặp oxihóa-khử có thế điện cực chuẩn lớn hơn có thể oxihóa được KL trong cặp có thế điện cực chuẩn nhỏ hơn.- dựa vào thế điện cực chuẩn của KL để sắp xếp nhỏ bên trái, lớn bên phải.
- viết phương trình phản ứng theo quy tắc anpha ( ).
KL trong cặp oxihóa-khử có thế ĐCC âm khử được ion H+ của dung dịch axit.
● Xác định suất điện động chuẩn của pin điện hóa:
Epin = E(+) - E(-)suất điện động của pin điện hóa luôn là số dương
● Xác định thế điện cực chuẩn của cặp oxihóa-khử:
E0pin X-Y = E0Yn+/Y - E0Xm+/XKhi biết E0pin X-Y, nếu biết E0Yn+/Y Þ E0Xm+/X
Ví dụ:
Xác định E0Ni2+/Ni. Biết E0pin Ni-Cu = 0,60 V, E0Cu2+/Cu = 0,34V
E0pin Ni-Cu = E0Cu2+/Cu - E0Ni2+/Ni
Þ E0Ni2+/Ni = 0,34 – 0,6 = -0,26 V
Ý kiến bạn đọc